Pada postingan kali ini, mari kita melanjutkan materi kimia organik berikutnya yaitu orbital atom. Mempelajari mengenai lokasi elektron. Berdasarkan prinsip ketidakpastian Heisenberg, lokasi yang pasti dari elektron tidak dapat ditentukan, kita hanya dapat menguraikan lokasi yang mungkin saja. Orbital atom adalah suatu daerah tiga dimensi (volume dari ruangan) yang berada di sekitar nukleus dimana posisi yang mungkin kita dapat menemukan elektron.
Terdapat 4 orbital atom, yiatu s, p, d, f, dimana dalam kimia organik, kebanyakan kita hanya menggunakan orbital atom s dan p karena dalam kimia organik, kita menggunakan atom karbon seringnya. Pada orbital atom, terdapat orbital atom 1s, 2s, dan seterusnya yang lebih tinggi. Perbedaannya adalah lokasinya/posisinya, orbital atom 1s terletak dekat dengan nukleus, sementara 2s terletak lebih jauh. Dalam orbital atom, kita perlu untuk mengetahui isitlah "nodus", nodus adalah area dimana kita tidak bisa menemukan elektron.
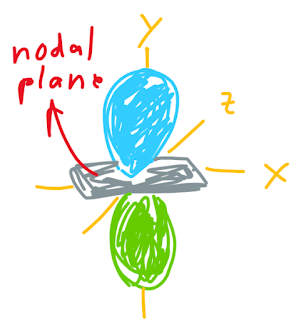
Orbital atom p memiliki 2 lobus, masing-masing lobus memiliki fase yang berbeda. Kita bisa membedakannya dengan warna yang berbeda. Fase tidak menunjukkan perbedaan dalam muatan. Nodus dalam orbital atom p disebut sebagai nodal plane. Sama seperti nodus salam orbital atom, terdapat nol kemungkinan kita dapat menemukan elektron dalam nodal plane.
Suatu orbital atom mengelilingi suatu atom, sementara orbital molekul mengelilingi molekul. Orbital molekul dapat memungkinkan kkita untuk melihat kemungkinan volume ruangan dari suatu elektron ketika suatu atom berikatan dengan atom lainnya agar melengkapi oktetnya. Dalam teori orbital molekul, setidaknya terdapat 4 istilah yang kita seharusnya ketahui, antara lain ikatan sigma, orbital molekul ikatan, orbital molekul anti-ikatan, dan ikatan pi.
Ikatan sigma adalah sautu ikatan kovalen ketika dua orbital s saling tumpang tindih. Bentuk ikatannya adalah silinder dan elektron secara simetris terdistribusi yaitu yang menghubungkan dua nukleus dari 2 orbital s.
Apa yang membuat ikatan kovalen terbentuk adalah saling tarik menarik dari dua elektron yang bermuatan negatif dan dua nukleus yang bermuatan positif. Dengan demikian, pada waktu ketika ikatan terbentuk, energi menurun. Semakin banyak orbital yang tumpang tindih, semakin banyak energi yang turun. Namun, terdapat batas sedekat apa orbital dapat saling tumpang tindih, yaitu pada waktu dua nukleus sudah terlalu dekat dan mulai saling tolak menolak. Jarak dari ikatan disebut sebagai panjang ikatan dan jarak ini adalah dimana stabilitas yang dimiliki yang paling maksimum.
Apabila ikatan ingin terdisosiasi, memnbutuhkan energi yang sama dengan energi yang dilepaskan ketika ikatan tersebut terbentuk. Dalam kata lain, membentuk ikatan akan melepaskan energi, sementara memutuskan ikatan akan memerlukan energi dimana jumlah energi yang dibutuhkan secara tepat sama dengan energi yang dilepaskan ketika ikatan terbentuk.
Ketika kita membahas orbital molekul, sebenarnya jumlah orbital molekul yang terbentuk adalah jumlah total dari orbital atom yang berikatan satu sama lain. Misalnya, jika dua orbital atom adalah ikatan hidrogen, artinya duat orbital molekul juga terbentuk. Sebelum ini, kita hanya berbiacara 1 orbital molekul, orbital molekul sisa lainnya adalah orbital molekul anti-ikatan.
Bagaimana kita bisa memiliki 2 jenis orbital molekul? Sebagaimana elektron bertindak seperti sifat mirip gelombang, elektron memiliki 2 sifat, yaitu sifata aditif dan sifat destruktif. Dimana sifat aditif ini dalam orbital moleul yang kita sebut sebagai orbital molekul ikatan sementara sifat destruktif ini yang disebut orbital molekul anti-ikatan (ikatan sigma bintang).
Orbital molekul ikatan dibentuk ketika gelombang dengan fase yang sama saling tumpang tindi secara konstruktif, sementara orbital molekul anti-ikatan dibentuk ketika gelombang dengan fase yang berbeda saling tumpang tindih secara destruktif.
Dalam orbital ikatan, dua fase yang sama saling menguatkan satu sama lain untuk membentuk ikatan. Sementara orbital molekul anti-ikatan, dua fase yang berbeda saling membatalkan satu sama lain sehingga tidak ada ikatan yang terbentuk.
Jika kita berbicara tentang energi, apda waktu dua orbital atom saling tumpang tindih, yang satu berada dalam energi yang lebih rendah (orbital molekul ikatan) dan yang satunya lagi berada dalam energi yang lebih tinggi (orbital molekul anti-ikatan).
Bagaimana cara menentukan elektron dalam orbital molekul adalah sama saja seperti pada orbital molekul atom. Elektron akan mengisi orbital molekul yang tersedia dari energi yang paling rendah terlebih dahulu yang mana merupakan orbital molekul ikatan. Dari gambar di ataws, kita bisa melihat orbital molekul ikatan berada pada energi yang lebih rendah daripada orbital molekul, sehingga lebih stabil. Peraturan lainnya, tidak ada lebih dari 2 elektron yang dapat menempati satu orbital. Dengan demikian, kita bisa melihat adanya H2. Dua elektron dari orbital atom hidrogen menempati orbital ikatan. Sementara tidak ada orbital molekul anti-ikatan sebagaimana memang jumlah elektron masing-masing hidrogen hanya 1. Bagaimana dengan He2? Apakah ada?
He2 tidak ada karena elektron totalnya adalah 4, dimana elektron valensinya 2, artinya jika ada 2 atom He, masing-masing 1 elektron, keduanya menempati orbital molekul ikatan, dan 2 elektron sisanya dari masing-masing atom He menempati orbital molekul anti-ikatan sehingga membatalkan terbentuknya ikatan.
Sekarang mari kita membahas mengenai ikatan pi, apakah bedanya antara ikatan sigma dan ikatan pi? Ikatan sigma adalah ikatan yang dibentuk apabila 2 orbital s saling tumpang tindih, sementara ikatan pi adalah ikatan yang terbentuk apabila dua orbital atom p saling tumpang tindih. Sama seperti ikatan sigma, ikatan pi juga memiliki orbital molekul ikatan dan anti-ikatan. Orbital molekul ikatan terbentuk apabila dua fase yang sama (in-phase) (lobus hijau dengan lobus hijau, lobus biru dengan lobus biru) orbital atomnya saling tumpang tindih sisi sama sisi. Sementara orbital molekul anti-ikatan terbentuk ketika dua fase yang berbeda (out-of-phase) (lobus hijau dengan lobus biru) orbital atomnya saling tumpang tindih sisi sama sisi.
Sampai di sini, masih ingat dengan struktur Lewis kan? Dari struktur Lewis, kita bisa melihat gambaran molekul mengenai bagaimana elektron pasangan bebas dan bagaimana ikatan terbentuk dalam molekul. Namun, bentuk dari molekul tidak dapat dipelajari dengan struktur Lewis. Jika kita ingin melihat sekilas dari bentuk molekul, kita bisa menggunakan model VSEPR (Valence-shell electron-pair repulsion). Model ini dapat memprediksi geometri dari molekul karena tidak hanya elektron dalam orbital molekul ikatan yang berperan dalam bentuk molekul, tetapi elektron pasangan bebas juga berperan.
Ingat bahwa pasangan bebas juga bermuatan negatif sehingga ketika ada ikatan, mereka akan dapat saling tolak menolak dan terposisikan sejauh mungkin. Itilah mengapa pasangan bebas juga mempengaruhi bentuk molekul.
Sekiranya cukup sekian untuk postingan kali ini. Semoga dapat bermanfaat, apabila ada yang salah, mohon dimaafkan. Terima kasih sudah berkunjung!
















0 comments:
Post a Comment
If you want to be notified that I've answered your comment, please leave your email address. Your comment will be moderated, it will appear after being approved. Thanks.
(Jika Anda ingin diberitahu bahwa saya telah menjawab komentar Anda, tolong berikan alamat email Anda. Komentar anda akan dimoderasi, akan muncul setelah disetujui. Terima kasih.)