Apa itu prinsip Le Chatelier? Kenapa disebut Le Chatelier? Prinsip Le Chatelier disebut juga hukum kesetimbangan adalah prinsip yang digunakan dalam memprediksi adanya efek perubahan dari beberapa faktor di dalam kondisi kesetimbangan. Prinsip ini disebut Le Chatelier, karena digagas oleh Bapak Henry Louis Le Chatelier. Prinsip ini dinyatakan sebagai,
"Ketika suatu sistem pada kesetimbangan mengalami perubahan konsentrasi, suhu, volume, atau tekanan, maka sistem menyesuaikan (sebagian) dirinya untuk meniadakan pengaruh perubahan yang diterapkan dalam keseimbangan baru tercapai."
Bapak Le Chatelier
sumber foto: dari google
Berdasarkan prinsip tersebut, ada 3 hal yang mempengaruhi keseimbangan reaksi, yaitu konsentrasi, suhu, volume atau tekanan. Apakah katalis mempengaruhi kesetimbangan? Hal ini dijawab di tulisan saya di sini.
Pertama, pengaruh perubahan konsentrasi terhadap kesetimbangan reaksi. Aturannya seperti ini, jika reaktan ditambah, maka reaksi bergeser ke arah produk (forward reaction), sebaliknya jika produk yang ditambah maka reaksi bergeser ke kiri (reverse reaction). Jadi, adanya penambahan konsentrasi pada satu sisi pada reaksi akan bergeser ke arah sisi lainnya, kalau di kiri yang ditambah, bergesernya ke kanan, kalau kanan yang ditambah, maka bergesernya ke kiri. Kenapa demikian? Bayangannya begini, Bayangkan kamu punya 2 wadah dengan jumlah sama, bayangkan kamu menambahkan bahan ke dalam wadah 1, agar bisa sama lagi jumlahnya apa yang kamu lakukan? Memindahkan bahan yang di wadah 1 sebagian ke kanan bukan? Supaya jumlahnya sama. Jadi seperti itulah prinsipnya jika dalam keseimbangan di reaksi, diganggu karena adanya penambahan salah satu konsentrasi.
Beda kalau dikurangi, jika konsentrasi reaktan dikurangi, maka arah reaksi bergeser ke kiri, arah reaktan, jika konsentrasi produk yang dikurangi, maka arah reaksi bergeser ke kanan, arah produk. Jadi, kalau dikurangi, sisi yang dikurangi, arah reaksi akan tetap sama ke arah sisi yang dikurangi. Jika kiri yang dikurangi, maka ke kiri, jika kanan yang dikurangi maka ke kanan. Nah kalau yang ini bayangannya bagaimana? Coba bayangkan, kamu memiliki dua wadah yang masing-masing jumlah bahan yang dimasukan sama. Lalu kamu mengurangi bahan yang ada di wadah 2, apa yang kamu lakukan supaya jumlahnya tetap sama? Tentu kamu berikan bahan dari wadah 1, supaya bisa menutupi kekurangan wadah 2 bukan? Ya, jadi sama prinsipnya seperti dalam reaksi yang seimbang, yang diganggu karena adanya pengurangan. Jika konsentrasi produknya diganggu, maka reaksi akan bergeser dari reaktan ke produk, agar konsentrasi produk dan reaktan dapat seimbang lagi.
Coba lihat contoh reaksi di bawah.
- Ke arah mana jika konsentrasi CH4 ditambah? Ya benar, ke arah kanan.
- Ke arah mana jika konsentrasi H2 ditambah? Ke arah kiri
- Ke arah mana jika konsentrasi CH4 dikurangi? Ke arah kiri
- Ke arah mana jika konsentrasi H2 dikurangi? Ke arah kanan
Kenapa kamu perlu memahami ini? Ini bisa dijadikan strategi, pada umumnya peneliti melakukan reaksi, bertujuan agar dapat memperoleh produk dengan yield yang banyak, melakukan sintesis senyawa kimia tentu agar dapat memperoleh produk senyawa yang diinginkan. Apakah mereka menginginkan jumlah reaktan yang lebih banyak dibanding produk? Tentu tidak, mereka menginginkan agar reaksi mereka berhasil, memperoleh konsentrasi produk sebanyak-banyaknya, menghabiskan hampir semua konsentrasi reaktan semaksimal mungkin. Jadi, ketika ada lebih banyak reaktan yang diamati ketimbang produknya, peneliti akan merasa gagal, karena tidak dapat menjalan reaksi sesuai dengan keinginan.
Oleh karena itu, menggunakan prinsip ini, peneliti menjadi tau cara untuk memaksimalkan konsentrasi produk, ada dua cara berdasarkan penjelasan di atas, yaitu dengan cara menambahkan konsentrasi reaktan dan/atau mengurangi konsentrasi produk.
Sampai di sini, sudah paham ya bahwa konsentrasi dapat merubah arah kesetimbangan. Lalu, apakah konsentrasi tersebut dapat merubah nilai konstanta kesetimbangan atau equilibrium constant (Kc)? Jawabannya tidak. Ingat dengan skenario dua wadah yang kita isi dengan jumlah bahan yang sama dalam kesetimbangan? Jika masing-masing sama-sama 2 M misal, konsentrasi pada reaktan dan produknya, maka Kc nya sama dengan 1, karena seimbang ya. Nah bayangkan kalau ada penambahan bahan ke wadah 1, seperti ilustrasi sebelumnya, akan ada sebagian bahan dari wadah 1 yang diberikan ke wadah 2, nah kalau dibayangkan seperti itu, apakah nilai keseimbangannya tetap sama? 1?
Iya dong tentunya, karena tujuannya adalah mencapai keseimbangan, yang awalnya 1, dengan jumlah yang sama di masing2 wadah, jadi biarpun ada penambahan atau pengurangan, kedua wadah berusaha untuk mencapai agar jumlahnya tetap, ya artinya pada akhirnya tetap nilai keseimbangannya, atau Kc nya tetap sama atau konstan. Jadi beginilah, alasan kenapa perubahan konsentrasi tidak merubah Kc atau nilai konstanta kesetimbangannya, karena respon yang terjadi akibat adanya gangguan atau perubahan, berusaha untuk mencapai nilai konstanta yang sama seperti sebelumnya. Harusnya jelas ya sampai sini.
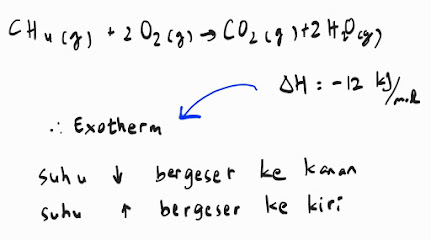
Kedua, pengaruh perubahan suhu terhadap kesetimbangan reaksi. Bagaimana cara suhu dapat mempengaruhinya, tergantung dari reaksi kimianya, apakah reaksinya itu endotherm atau exotherm. Ingat kan apa bedanya? Reaksi endothermik atau endotherm adalah reaksi yang memerlukan atau menyerap energi, ditandai dengan nilai entalpinya yang positif, sementara reaksi eksotermik atau exotherrm, adalah reaksi yang menghasilkan atau melepas energi (bisa dalam bentuk panas), ditandai dengan nilai entalpinya yang negatif.
Energi bisa diberikan dalam bentuk panas. Berhubung reaksi endotherm itu adalah reaksi yang menyerap panas, maka apabila diberi peningkatan suhu, artinya makin panas kan? Reaksi endotherm akan menyukainya sehingga reaksinya itu selaras dengan pembentukan produk. Sebaliknya, jika reaksi endotherm itu diturunkan suhunya, tidak ada energi yang diserap, produk tidak akan terbentuk, reaksi bergeser ke kiri, ke arah reaktannya.
Begitu pula pada reaksi exotherm, berhubung reaksi ini menghasilkan panas, maka ketika suhunya diturunkan, akan lebih disukai, pembentukan produk disukai, tapi kalau ditingkatkan suhunya, padahal reaksi exotherm tidak memerlukan energi panas, maka produk tidak terbentuk, reaksi bergeser ke kiri, ke arah reaktan.
Artinya, jika kamu mengingikan konsentrasi produk yang maksimal, pada reaksi endotherm, kamu dapat meningkatkan suhunya, jangan diturunkan, sementara pada reaksi exotherm, kamu dapat menurunkan suhunya, jangan dinaikan.
Kalau ada perubahan suhu, apakah akan ada perubahan konstanta kesetimbangan? Saat kita membahas perubahan konsentrasi, tidak ada ya pengaruhnya, nilai Kc tetap sama. Nah, kalau ada perubahan suhu, jadi berbeda. Nilai konstantanya berbeda. Kok bisa? Bayangkan lagi kamu punya dua wadah, wadah 1 dan wadah 2, wadah 1 adalah reaktan, wadah 2 adalah produk. Bayangkan reaksinya adalah reaksi endotherm, yang menyerap energi atau panas. Ingat apa yang terjadi kalau ditingkatkan suhunya? reaksi akan bergeser ke produk, artinya akan ada banyak jumlah produk diperoleh. Nah, seandainya, kita panaskan suhunya, maka akan ada lebih banyak bahan yang kita akan peroleh di wadah 2, dari mana asalnya? dari bahan-bahan di wadah 1 yang dipindahkan, karena peningkatan suhu menyebabkan reaksi bergeser ke arah produk.
Akibat hal ini, apakah sama jumlah bahan pada wadah 1 dan wadah 2? Tentu berbeda, yang tadinya sebelum ada peningkatan suhu, jumlahnya sama, nah setelah ada peningkatan suhu, jumlah bahan di wadah 1 berkurang, dan wadah 2 bertambah. Oleh karena itulah, nilai konstanta kesetimbangannya berubah. Anggap lah sblm peningkatan suhu sama-sama 2 M. Ketika ada peningkatan suhu, di wadah 1 jadi 1 M, wadah 2 jadi 3 M. Kc berubah jadi 3/1 = 3, yang tadinya 2/2 = 1 (seandainya tidak ada koefisien di depan senyawanya ya). Jadi, begitulah bagaimana suhu dapat merubah nilai Kc.
Terakhir, perubahan volume/tekanan, bagaimana kah pengaruhnya terhadap arah kesetimbangan? Volume dan tekanan adalah satu kesatuan yang saling berbanding terbalik. Jika kita beri tekanan, maka volume mengecil, jika kita longgarkan tekanannya, volume membesar.
Aturannya dalam hal ini, jika kita beri tekanan, maka arah kesetimbangan akan bergeser ke arah yang jumlah molnya lebih kecil, sebaliknya, jika kita kurangkan tekanannya, akan bergeser ke arah yang jumlah molnya lebih besar. Sebagai contoh:
Pada persamaan reaksi kimia di atas, jumlah mol yang diindikasikan dengan koefisien tiap-tiaps senyawanya, total mol 3 di sisi reaktan, sementara di sisi produk, jumlah mol = 2. Artinya jumlah mol di kiri lebih banyak dari pada jumlah mol di kanan. Nah, kalau kita beri tekanan, ingat ke mana arah reaksinya? Akan bergeser ke arah sisi yang jumlah molnya sedikit, yang sedikit yang mana? Yang di kanan bukan? Artinya akan bergeser ke kanan, ke arah produk. Sebaliknya, jika kita kurangi tekanannya, maka akan bergeser ke arah yang lebih banyak molnya, yaitu yg sebelah kiri, ke arah reaktan.
Bagaimana jika jumlah molnya sama baik di kiri dan di kanan seperti contoh persamaan reaksi di bawah ini?
Maka tidak akan ada perubahan, tidak ke kanan ataupun tidak akan ke kiri, reaksi akan berada pada kesetimbangan.
Apakah perubahan tekanan mempengaruhi perubahan nilai Kc? Jika konsentrasi tidak, suhu iya, bagaimana dengan tekanan? Sama seperti konsentrasi, tekanan tidak akan merubah nilai Kc. Penjelasan lebih jauh, bisa lihat di postingan yang ini.
Kesimpulannya, berdasarkan prinsip Le Chatelier, atau hukum kesetimbangan. Suatu reaksi kimia yang ada dalam kesetimbangan, dapat bergeser apabila dipengaruhi oleh adanya perubahan konsentrasi, suhu, dan volume/tekanan. Lebih lanjut, ketiganya tidak mempengaruhi nilai konstanta kesetimbangannya atau Kc, konsentrasi dan tekanan tidak merubah Kc, hanya suhu saja yang merubah Kc.
Untuk topik ini, sekian dari saya. Mohon maaf apabila terdapat kesalahan. Terima kasih sudah berkunjung